«Родная кровь»: ликбез по ТКМ
Чаще всего словосочетание «трансплантация костного мозга» (точнее, трансплантация гемопоэтических, или кроветворных, стволовых клеток) встречается в связи со сбором средств на поиск и активацию неродственного донора этих клеток.
Наш фонд также собирает деньги на лекарства, которые нужны до или после трансплантации, на наборы для очистки трансплантата или системы для фотофереза.
В общем, хоть сама процедура трансплантации и оплачивается государством, некоторые ее части — то, без чего она не могла бы состояться или была бы связана с риском тяжелых осложнений, — не входят в стоимость квоты. Кроме того, постоянно появляются новые трансплантационные технологии и новые лекарства. А включить что-нибудь новое «в счет» государству — дело по определению небыстрое. Поэтому практически ни одна пересадка не обходится без благотворительной помощи. И если вы хотите разобраться, на что же именно идут пожертвования с назначением «на проект ТКМ», наш ликбез «Родная кровь» — для вас.
Пересадка растений // Что нужно знать при пересадке растений?
Существует два вида трансплантаций гемопоэтических стволовых клеток — аутологичная и аллогенная. При аутологичной у пациента берут его собственные клетки, замораживают, дают больному высокие дозы химиотерапии и затем возвращают клетки обратно. «Аутологичная пересадка с точки зрения трансплантолога — вообще не трансплантация, — говорит Михаил Масчан, врач-гематолог, зам. директора НМИЦ ДГОИ им.
Дмитрия Рогачёва. — Потому что там нет никаких иммунологических реакций, никакого донора там нет. Весь смысл аутопересадки в том, что клетки костного мозга очень чувствительны к химиотерапии, и есть такие дозы химиотерапии, которые можно дать, только защитив клетки костного мозга. Мы их и защищаем — в холодильнике. А потом возвращаем пациенту.
Есть опухоли, при которых эта добавка в дозе химиотерапии увеличивает шансы на выздоровление». С точки зрения сбора средств ауто-ТКМ тоже обычно не представляет интереса, так как практически все связанные с ней расходы оплачиваются государством.
Второй вид трансплантации — аллогенная, при которой клетки берут у донора и пересаживают пациенту. «Аллогенная пересадка — это всегда вопрос спасения жизни, — продолжает Михаил Масчан. — Это очень дорогая процедура с большими рисками для пациента, и без абсолютной уверенности, что это необходимо, ее не делают. Лечебный эффект аллогенных ТКМ складывается из двух вещей: это высокие дозы химиотерапии и иммунологическая реакция, которая появляется в результате замены костного мозга пациента на донорский».
Именно аллогенные пересадки имеются в виду, когда мы говорим о «трансплантации костного мозга» и о сборе средств на нее. ТКМ применяются при двух больших группах болезней — это опухоли, такие как лейкозы, и это врожденные болезни крови и первичные иммунодефициты, такие, например, как тяжелая комбинированная иммунная недостаточность.
Как проходит трансплантация костного мозга? «Сначала, примерно за семь дней перед пересадкой, проводится химиотерапия, — рассказывает Михаил Масчан. — Она называется кондиционированием. Потом день, когда мы переливаем собственно клетки донора, это похоже на обычное переливание крови. Потом проходит примерно три недели до того момента, когда приживаются донорские клетки, появляются лейкоциты, и мы говорим: да, трансплантат прижился. Потом проходит еще примерно 4-12 месяцев, за которые иммунная система восстанавливается.
Как рассчитать время на пересадку в аэропорту? Сколько времени нужно на пересадку? — Отдых
Гемопоэтические стволовые клетки (ГСК)
Дело в том, что после пересадки вся иммунная система заменяется на донорскую целиком. И вот замена иммунной системы — это долгий и постепенный процесс. И когда мы говорим «мы сделаем пересадку», мы имеем в виду не сам этот день пересадки, и даже не тот кусочек, когда прижился костный мозг, а вот это все — этот период от четырех месяцев до года, после которого иммунная система восстановилась и мы фактически считаем, что пациент может возвращаться к обычной жизни. Делать заново прививки от детских инфекций, идти в школу, на работу».
В зависимости от того, кто становится донором, аллогенные трансплантации бывают трех видов: от совместимого родственного, от совместимого неродственного и от не полностью совместимого родственного донора. История ТКМ и в мире, и в России началась с пересадок от совместимых родственных доноров.
Этап 1. Пересадки от совместимых родственных доноров
Трансплантации костного мозга стали проводиться в России еще в 90-е годы XX века. Первые трансплантации были проведены в Российской детской клинической больнице в Москве и в Санкт-Петербургском ГМУ им. Павлова четверть века назад, и тогда же появились первые дети, спасенные с их помощью. При этом в те годы донорами чаще всего становились братья и сестры больных детей.
Почему? Дело в том, что ТКМ связана с риском серьезных осложнений. И одно из самых грозных — реакция «трансплантат против хозяина» (РТПХ), конфликт между донорскими иммунными клетками и организмом больного. Ведь при трансплантации пациент получает иммунную систему донора, для которой его собственные клетки являются чужими.
Тяжелые формы РТПХ часто приводят к гибели больного или к тяжелой инвалидности. Чтобы снизить риск осложнений, донора подбирают по принципу так называемой тканевой совместимости: белки и гены, отвечающие за узнавание клеток иммунной системой, у донора и больного должны быть одинаковыми или почти одинаковыми.
Вероятность такого совпадения со «случайно взятым» посторонним человеком очень низка, буквально доли процента, поэтому подбор донора становится серьезной проблемой. А вот для родных братьев и сестер вероятность гораздо выше: согласно законам генетики, каждый родной брат или сестра с вероятностью 25% может оказаться полностью совместимым донором для больного ребенка.
Действительно, многие из таких пересадок проходили удачно. Но получалось, что шанс на пересадку имело, по оценкам врачей, лишь 15% детей: в большинстве российских семей всего 1-2 ребенка, и наличие совместимого донора в семье было большой и редкой удачей…
Этап 2. Пересадки от совместимых неродственных доноров
Поэтому на рубеже девяностых и нулевых годов внимание российских врачей привлекла другая возможность: если в семье нет подходящего донора, можно провести пересадку от **совместимого неродственного донора** В самом деле, если у нас есть данные о многих сотнях тысяч людей, готовых стать донорами костного мозга (гемопоэтических стволовых клеток), среди этих людей с достаточно высокой вероятностью можно выбрать генетически подходящего. Для этого создаются специальные базы данных — регистры потенциальных доноров.
Первая неродственная пересадка была произведена в России в 1997 году и оказалась успешной. Но лишь через несколько лет удалось поставить их «на поток». Ведь в России не было своего регистра доноров костного мозга, и приходилось обращаться в зарубежные, такие как регистр фонда Штефана Морша в Германии.
И хотя сам донор отдает свои клетки бесплатно — единственной наградой для него является возможность спасти чужую жизнь, — затраты все равно весьма значительны. Денег стоит и поиск в зарубежном регистре, и углубленные анализы, и обследование донора, и оплата его поездки в клинику, и страховка, и сама процедура взятия клеток, и их транспортировка — словом, всё то, что мы имеем в виду под словами «расходы на поиск и активацию донора». Государство не берет на себя расходы, связанные с зарубежными регистрами, и поэтому пересадки от неродственных доноров и в начале «нулевых» годов, и сейчас зависят в первую очередь от благотворительной поддержки.
В боксе отделения ТКМ
Прошли годы. Пересадки от неродственных доноров стали в России гораздо доступней: они проводятся (по-прежнему при поддержке благотворительных фондов) уже в большем числе клиник. Понемногу формируется и российский донорский регистр: в нем уже десятки тысяч потенциальных доноров — и расходы на их поиск и активацию куда меньше, чем при обращении в зарубежные регистры. Однако с неродственными трансплантациями связаны и существенные ограничения.
Во-первых, это фактор времени. Поиск и активация неродственного донора происходят небыстро, обычно речь идет о нескольких месяцах. Но если у ребенка агрессивный лейкоз и трансплантация нужна срочно, этих нескольких месяцев может просто не быть в запасе. Во-вторых, не всегда удается найти совместимого неродственного донора.
Особенно часто это случается, если больной принадлежит к редкой этнической группе — скажем, к одному из народов Кавказа или Крайнего Севера. Но и в других случаях, увы, полной гарантии нет. В-третьих, даже при трансплантации от полностью совместимого неродственного донора риск тяжелых форм РТПХ все же довольно высок. Врачи могут вспомнить немало трагических историй, когда они теряли пациентов именно из-за этого осложнения…
И хотя неродственные пересадки и сейчас играют немалую роль, в детской трансплантологии в последние годы происходит частичный переход к другому подходу — к пересадкам от частично совместимого родственного донора. Они также называются гаплоидентичными трансплантациями или просто гаплотрансплантациями.
Этап 3. Гаплоидентичные трансплантации
Ребенок получает половину генов от отца, а половину — от матери. Это значит, что каждый родитель на 50% генетически совместим со своим ребенком. Казалось бы, этого мало для успешной трансплантации — всегда считалось, что шанс избежать тяжелой РТПХ есть только в случаях, когда степень совместимости близка к 100%. Но в последние годы во многих мировых клиниках разработаны и внедрены технологии, позволяющие производить успешные пересадки даже при половинной совместимости.
Одна из этих технологий с 2012 года используется в Центре детской гематологии имени Дмитрия Рогачева, а сейчас и еще в нескольких отечественных центрах. Это так называемая очистка трансплантата. Суть ее заключается в том, что из клеток, взятых у донора (а это всегда смесь многих разных видов клеток), удаляются именно те, которые и являются главной причиной РТПХ. И только после этого «очищенная» смесь клеток вводится больному.
Долгое время врачи волновались, насколько эффективной будет эта технология. Не приведет ли ее использование, например, к росту числа рецидивов лейкоза после пересадки? Или к другим проблемам?
К счастью, опасения не оправдались. При остром лимфобластном лейкозе число рецидивов не увеличилось, а при пересадках пациентов с острым миелоидным лейкозом даже заметно уменьшилось! С инфекционными осложнениями тоже научились бороться. Есть и другие преимущества: сократилось среднее время приживления трансплантата. Но главное – что тяжелые формы РТПХ действительно стали встречаться намного реже.
Применение гаплоидентичных трансплантаций позволило решить две важнейшие проблемы: доступности донора и срочности пересадки. В самом деле, почти у каждого пациента кто-то из родителей может быть донором. Или если не родители, то другие родственники, наполовину совместимые с ним: братья и сестры (здесь вероятность половинного совпадения — 50%), иногда дяди и тети.
Родители всегда рядом и всегда готовы поделиться клетками, чтобы спасти сына или дочь. Не надо тратить драгоценные месяцы на поиск другого донора. И сейчас, например, в Центре детской гематологии при острых лейкозах проводятся почти исключительно гаплоидентичные трансплантации, если, конечно, в семье нет полностью совместимого донора.
Тем не менее неродственные трансплантации по-прежнему сохраняют свою значимость, и не только у взрослых (для которых гаплотрансплантация часто является не лучшим вариантом из-за слишком медленного восстановления иммунитета), но и у детей, в том числе в Центре детской гематологии. Во-первых, они широко применяются при незлокачественных заболеваниях, таких, например, как первичные иммунодефициты. Во-вторых, иногда бывает так, что подходящих родственных доноров у ребенка нет — например, если он сирота.
Куда уходят деньги
Значительная часть расходов на трансплантацию покрывается за счет государственной квоты. Но, к сожалению, не все. В этом смысле дешевле всего в качестве доноров обходятся совместимые братья и сестры. Строго говоря, при наличии квот на ТКМ (а если точнее, финансирования по госзаданию) активация совместимых родственных доноров не стоит благотворителям ничего. Правда, квоты в российских больницах имеют тенденцию заканчиваться, и тогда активация обходится в сумму от 150 до 400 тысяч рублей.
При неродственных трансплантациях необходимо оплачивать поиск и активацию донора в зарубежных регистрах — ведь в российском регистре пока удается найти доноров лишь небольшому числу пациентов. Получается очень значительная сумма: от 1,6 (в обычных случаях) до 3 миллионов рублей (если донор, например, найден не в Европе, а в Америке или Японии).
При гаплоидентичных трансплантациях расходов на поиск и активацию нет, но есть другие — на очистку трансплантата. Разделение смеси клеток – сложная процедура, требующая не только специального оборудования, но и использования дорогостоящих реактивов и расходных материалов.
С учетом расходов на их покупку процедура очистки может стоить от 800 тысяч до 1 млн 400 тысяч рублей. Это, безусловно, тоже немало, но все же в два раза меньше, чем затраты на неродственные ТКМ. Другой, не менее важный фактор (в том числе и с финансовой точки зрения) — пациенты после таких трансплантаций быстрее восстанавливаются, им нужно меньше переливаний крови, они быстрее выписываются из больницы и гораздо реже, чем когда-то, возвращаются туда с тяжелыми осложнениями, требующими многомесячной терапии. Но главное — гаплоидентичные трансплантации с применением очистки ежегодно дарят здоровье и благополучие десяткам детей, и это не измеришь никакими деньгами.
ИсточникОбъяснилась тайна почерневшей перед смертью руки Елизаветы II
Эта фотография стала последней в жизни королевы Великобритании Елизаветы II. Она сделана за день до ее смерти во время визита в Балморал только что назначенного премьер-министра Лиз Трасс. Опираясь левой рукой на трость, Елизавета Вторая протягивает правую Трасс. И видно, что по ее кисти расползается уродливое иссиня-черное пятно, как будто бы та обуглена.

Снимок обошел весь мир, заставив гадать: что это за недуг поразил королеву накануне кончины? Связан ли он как-то с ее пусть и ожидаемым, но все же относительно неожиданным уходом: неужели это своеобразная «метка смерти»?
Мы попросили прокомментировать причины возможного появления этого пятна специалистов.
На самом деле это вовсе не единственное фото, на котором Елизавета запечатлена со столь странной отметиной. В 2019 году Елизавета II принимала в Букингемском дворце прибывших в Лондон с визитом короля Иордании Абдаллу II и его супругу королеву Ранию. На странице Букингемского дворца в Twitter был опубликован снимок, на котором Елизавета в белом платье позирует перед камерой вместе с гостями и своей единственной дочерью — принцессой Анной. Верноподданные королевы были в шоке от состояния ее левой руки. На снимке она была какого-то невероятного черно-фиолетового оттенка.
«Боже… Выглядит так, как будто Ее Величество поранила руку… Надеюсь, она быстро заживет», — прокомментировал один из пользователей новость, посвященную визиту. Кое-кто предположил, что королева ударилась, случайно обожглась или имеет огромные проблемы с сосудами. А некоторые и вовсе испугали общественность размышлениями в духе «не гангрена ли это, не онкология ли?».
Тогда же хирурги-флебологи предположили, что это может быть травма. Возможно, что королева просто споткнулась и ударила руку.
«Если это пятно появилось достаточно давно, минимум полгода назад, то можно было бы без УЗИ предположить, что начинается гангрена», — заключили эксперты.
Все лица наследников Елизаветы II: галерея королевской семьи

Смотрите фотогалерею по теме
Ну как такое может быть? Не уследили? Все же первое лицо в государстве!
Так как с черным пятном королева прожила еще три года, понятно, что речь шла не о гангрене. Заговорили и о запущенной форме атеросклероза.
«Синяк-то ладно, вы посмотрите на последней фотографии, что там с пальцами: они совсем белые, судя по всему, у королевы последние дни ее жизни совсем не было кровоснабжения, – согласился анонимно высказать свою точку зрения один из российских экспертов. – По характеру пятна видно, что, скорее всего, оно от катетера. Видимо, жизнь в Елизавете уже давно поддерживали сильнодействующими препаратами.
Она постоянно находилась на капельницах. По-научному: у нее была высокая проницаемость стенок венозных сосудов, сосуды очень ломкие. И вот результат. Естественно, умерла королева не из-за этого. Просто время пришло».
Как же удавалось Елизавете скрывать этот дефект от подданных? Ведь слухи о пятне и его связи со смертью королевы поползли только сейчас.
Все очень просто. Почти все семьдесят лет своего правления Елизавета носила на публике перчатки из белоснежного хлопка с обработкой под велюр. Мало кто мог увидеть обнаженными ее пальцы.
Елизавете II приходится встречаться с большим количеством людей, постоянно приветствовать их и пожимать руки. Перчатки были призваны защитить королеву от микробов и других потенциальных опасностей, ведь у Ее Величества просто не было времени на то, чтобы хворать.
По оценкам экспертов, за десятилетия Елизавета сменила не менее сотни пар перчаток. На самом деле это не так уж и много.
Причем некоторые из них она бережно хранила и по 40 лет. Журналистам изготовитель королевских перчаток (их целая династия!) однажды эксклюзивно сообщила: «Думаю, что члены королевской семьи хотят, чтобы их считали экономными, а не тратящими большие суммы на подобные вещи».
Все же фирменный образ королевы – «это поднятая в приветствии рука в белой перчатке», им она навсегда и запомнится, а не согбенной и почти бесплотной старушкой на своем последнем снимке.
ИсточникЧем рискует донор: влияет ли донорство на здоровье
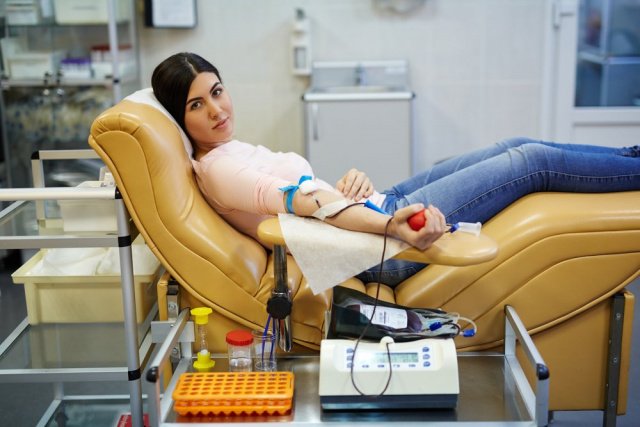
14 июня отмечается Всемирный день донора крови. Дата выбрана неслучайно — в этот день в 1868 году родился нобелевский лауреат Карл Ландштейнер, который был удостоен премии за открытие четырех групп крови. Сегодня донорство считается почетным и всячески поддерживается международными медицинскими организациями. И это неудивительно, ведь такая практика ежедневно спасает множество жизней. Наибольшая потребность существует именно в донорах крови, но популяризируются и другие программы — по пересадке органов и костного мозга.
Для реципиента донор — это шанс на жизнь. Но насколько опасна такая процедура для самого донора? Есть ли скрытые риски для здоровья? В вопросе разбирался MedAboutMe.
Переливание крови
Говоря о донорстве, чаще всего упоминается кровь. Действительно, переливание крови и ее компонентов широко применяется в медицине. Такая помощь может потребоваться планово — при лечении тяжелых болезней, или же экстренно — при получении тяжелых травм.
У донора за один раз берется не более 450 мл цельной крови, что составляет около 10% от ее общего объема в организме. У большинства пациентов такие потери никак не сказываются на здоровье, а если недомогания и появляются, то только в первые часы после самой процедуры. Так, иногда доноры жалуются на головокружения, слабость, потемнение в глазах, у некоторых случаются обмороки.
Восстановление занимает относительно небольшое время, по общим рекомендациям, цельную кровь можно снова сдавать уже через 2 месяца, но при этом общее количество донаций в год не должно превышать 5 у мужчин и 4 у женщин.
Процедура сдачи крови безвредна, более того, врачи отмечают положительные стороны для доноров:
- Регулярная диагностика на инфекции (вирусные гепатиты, ВИЧ и другие).
- Меньший риск сердечно-сосудистых заболеваний.
- Организм легче переносит кровопотери.
Переливание компонентов крови
Процедура забора цельной крови займет не более 10 минут, а вот ее компонентов — намного дольше. Например, сдача тромбоцитов продолжается около 1,5 часов. Это связано с тем, что кровь донора должна пройти через сепараторы, в которых из нее и выделяются необходимые компоненты.
Недомогания при донорстве цельной крови связаны с потерей эритроцитов — красных кровяных телец с гемоглобином, переносящим кислород к клеткам. Люди могут ощущать симптомы, похожие на признаки анемии. И если речь идет о донорстве компонентов крови, сдача эритроцитарной массы имеет наибольшее количество противопоказаний.
Наиболее легко переносится донорство тромбоцитов и плазмы. Уровень тромбоцитов восстанавливается очень быстро, теоретически донором можно вновь стать уже через 2 недели. Основные проблемы связаны с использованием цитрата натрия. Это вещество необходимо для того, чтобы забранная тромбоцитарная масса не сворачивалась.
Но при этом антикоагулянт связывает кальций и теоретически может ослаблять кости донора. При частом попадании вещества в кровь развивается цитратная реакция: организм плохо переносит вещество, человек может ощущать существенное ухудшение самочувствия. Поэтому процедуру не стоит проходить чаще, чем раз в 2-3 месяца. Также врач может порекомендовать прием комплексов витаминов и минералов, включающих глюконат кальция.
Гранулоциты — разновидность белых кровяных телец (лейкоцитов), которые отвечают за иммунитет и играют важную роль в борьбе с инфекциями. Донорство гранулоцитов — редкая процедура, достаточных данных о ее влиянии на здоровье пока нет. За 12 часов до процедуры донорам делается инъекция Филграстима. Препарат помогает гранулоцитам выходить из костного мозга, повышая их концентрацию в крови. Именно Филграстим вызывает наибольшие опасения, однако сегодня нет подтверждения, что его применение негативно влияет на здоровье.
Рекомендации перед сдачей крови
Потенциальный донор крови должен пройти обязательное обследование, которое включает анализ на инфекции и оценку уровня гемоглобина. К сдаче крови не допускаются люди с артериальным давлением ниже 100/60 или с любыми признаками плохого самочувствия.
Неприятные симптомы чаще всего возникают при следующих факторах риска:
- Сдача крови натощак, поэтому последний прием пищи должен быть за 2-3 часа до процедуры.
- Недостаточное питье.
- Недосыпание накануне.
- Сильное переутомление, общая слабость.
- Эмоциональное напряжение.
Чтобы избежать обморока, во время процедуры рекомендуется периодически напрягать мышцы ног или сжимать в руке небольшой мячик. Это поможет поддерживать артериальное давление на нужном уровне. Также не стоит резко вставать после того, как забор крови окончен. Лучше всего еще около часа посидеть в спокойной обстановке, выпить стакан сока или сладкого чая, съесть десерт или закуску.
Доноры костного мозга
Донором крови может стать любой человек, не имеющий противопоказаний. Донорами костного мозга или органов становятся только те, чей биологический материал подошел конкретному реципиенту.
Человек, готовый сдать гемопоэтические стволовые клетки (именно их забирают, когда речь идет о донорстве косного мозга), сначала проходит все необходимые анализы и, если противопоказаний нет, сдает кровь на типирование. Для этого отбирается всего 9 мл. В лаборатории материал изучается на HLA — цепочки генов тканевой совместимости. Они должны полностью совпадать с параметрами реципиента, поскольку в противном случае развивается отторжение. HLA — длинный участок генома (набор генов), и идентичные образцы встречается редко.
Поэтому на начальном этапе информация о HLA попадает в специальные регистры. Именно в них ищут подходящие для реципиентов гемопоэтические клетки. Некоторые люди становятся донорами лишь спустя несколько лет после регистрации, а другие так и остаются потенциальными кандидатами. Если материал все же подойдет, с потенциальным донором связываются, и при его согласии он заново проходит все необходимые анализы.
Забор гемопоэтических клеток проводится непосредственно из костного мозга или же из периферической крови. Метод выбирает сам донор.
- В первом случае человека вводят в наркоз и забирают небольшую часть клеток из крыла тазовой кости. После процедуры человек проводит несколько дней в стационаре.
- Чтобы получить достаточное количество клеток из периферической крови, человеку дают специальные препараты (Филграстим, Ленограстим), которые стимулируют их выход из костного мозга. Процедура напоминает забор компонентов крови. При этом саму кровь донор не теряет — она проходит через сепаратор, отделяющий гемопоэтические стволовые клетки, и возвращается в организм.
Восстановление костного мозга у доноров занимает 2 недели. В первые дни могут появляться симптомы, напоминающие грипп, но опасности они не представляют. Теоретически донором костного мозга можно стать уже через 3 месяца, организм к этому времени полностью восстанавливается, однако большинство людей проходят процедуру лишь один раз в жизни.
Трансплантация органов: донорство печени и почки

Прижизненное донорство, согласно закону о трансплантации, возможно для пересадки печени или почки. И конечно, по сравнению с донорством крови или костного мозга эта процедура намного сложнее.
Печень — единственный орган в человеческом теле, кроме кожи, способный регенерироваться. Поэтому для пересадки используется лишь часть печени. Уже приблизительно через полгода после операции она вырастает до 85% от своей изначальной массы, а в течение года может восстановиться полностью. Поэтому такое донорство хоть и требует длительной реабилитации, все же не связано с необратимыми последствиями для здоровья.
Печень структурно разделена на две доли, поэтому в ходе операции при отделении одной из них нет риска кровотечения или других серьезных осложнений. В стационаре донор остается еще неделю после операции. В период восстановления он должен наблюдаться у гепатолога.
Пересадка почки — более тяжелая операция, поскольку впоследствии донор остается без органа и получает инвалидность. При этом исследования показывают, что при здоровых органах человек с одной почкой может прожить столько же, сколько и с двумя.
Так, по данным метаанализа, опубликованным в Annals of Internal Medicine, у доноров действительно повышается риск развития терминальной стадии хронической почечной недостаточности (ТХПН), однако незначительно. Среди бывших доноров ТХПН встречался у 5 на 2000 человек, тогда как среди контрольной группы у 1 на 2000 человек. В исследовании оценивались данные 118 426 живых доноров и 117 656 человек контрольной группы. Других рисков, в том числе развития сердечно-сосудистых заболеваний и диабета, выявлено не было.
Ученые из The Johns Hopkins University School of Medicine изучили данные более 80 000 пациентов, которые стали донорами почки в 1994-2009 годах, и выяснили, что риск смерти у доноров спустя 5 и 12 лет не возрастает по сравнению с контрольной группой. То есть трансплантация не влияет на продолжительность жизни, а реальные риски, как и в случае других операций, связаны только с самим хирургическим вмешательством (3,1 случая на 10 000 пациентов).
Источник